Damos início a partir de agora ao estudo de um dos instrumentos mais importantes no universo da Química – a tabela periódica dos elementos.
Vamos deixar de lado toda a abordagem histórica que traduz a origem da
tabela por fugir dos nossos propósitos. O que é relevante saber é que a
tabela que utilizamos atualmente foi elaborada por Dmitry Mendeleev,
químico russo. A distribuição dos elementos na tabela está em
consonância com os estudos de Bohr e Rutherford no que diz respeito a
distribuição eletrônica.
Tabela periódica atual:
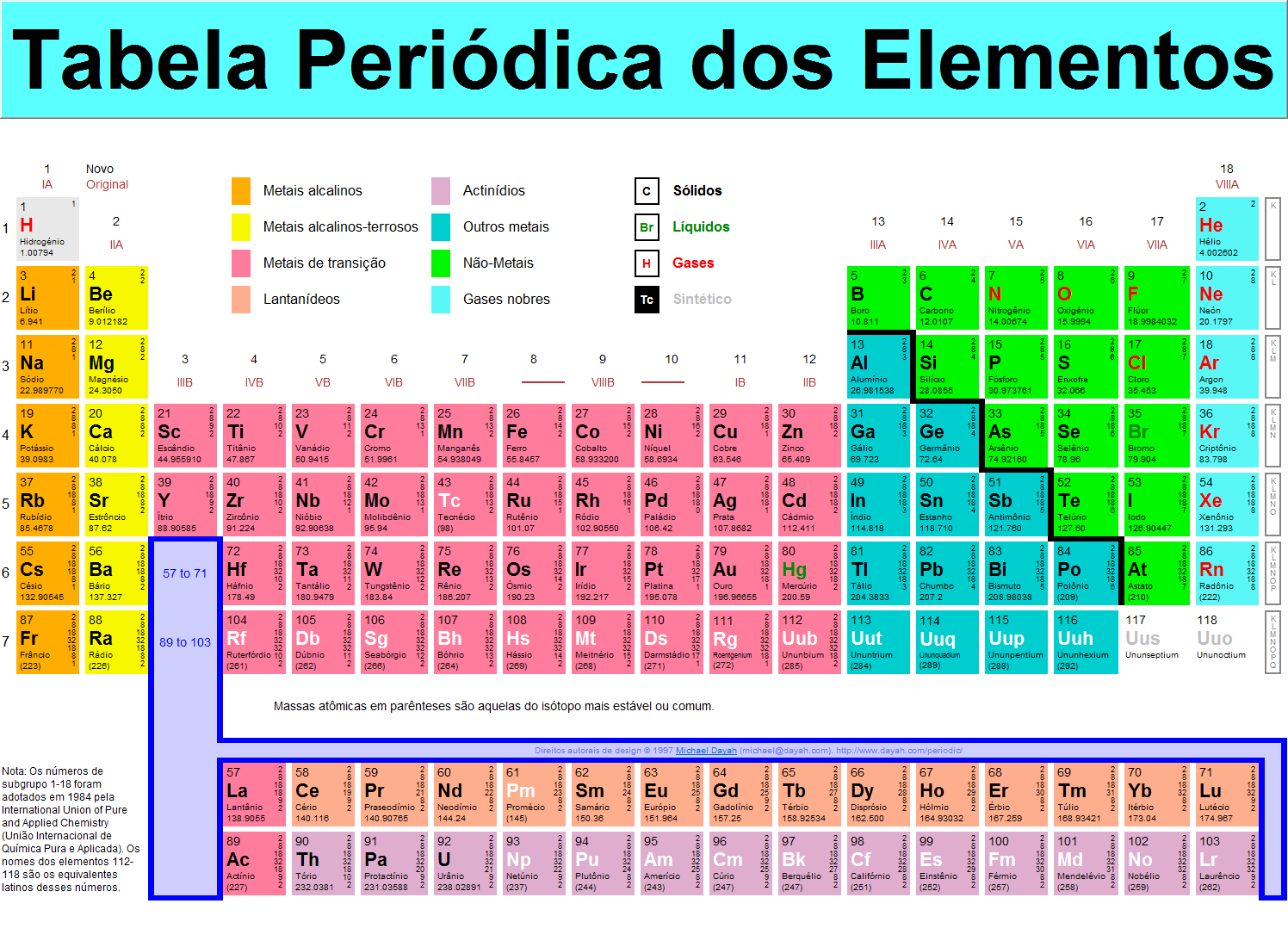
Tabela criada por Dmitry Mendeleev.
Os elementos na tabela estão dispostos em ordem crescente de número atômico, formando linhas chamadas de períodos, e colunas chamadas de famílias ou grupos.
Atualmente são conhecidos 118 elementos químicos, contudo a IUPAC
reconhece apenas 114 deles, estando em vias de reconhecimento dos
outros.
Períodos
São as setes linhas da tabela e correspondem exatamente às sete camadas na distribuição eletrônica. Exemplo: se um elemento localiza-se no 5º período, significa que existem elétrons na sua quinta camada.
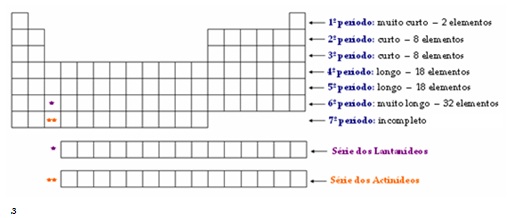
No
6º e 7º períodos há a série dos lantanídeos e dos actinídeos. Para
facilitar a ilustração da tabela, eles são propositalmente colocados em
séries destacadas. Caso isso não fosse feito, a tabela ficaria muito
comprida e, por conseguinte, com difícil representação.
Grupos ou famílias
São
as colunas da tabela periódica. É a classificação mais intimamente
ligada às propriedades comuns dos elementos. Em alguns grupos, tais
elementos possuem propriedades químicas muito parecidas. Antigamente, as
colunas eram numeras por 1A, 2A, 3B, 4B etc. Atualmente, porém, são
numerados simplesmente de 1 a 18. Além da numeração, as famílias podem
ser chamadas pelo nome do primeiro elemento do grupo ou por nomes que já
se popularizaram, a saber:
1 – metais alcalinos: Li, Na, K, Rb, Cs e Fr 2 – Metais alcalinoterrosos: Be, Mg, Ca, Sr, Ba e Ra 17 – Halogênios: F, Cl, Br, I, At 16 – Calcogênios: O, S, Se, Te, Po 18 – Gases Nobres: He, Ne, Ar, Kr, Xe e Rn
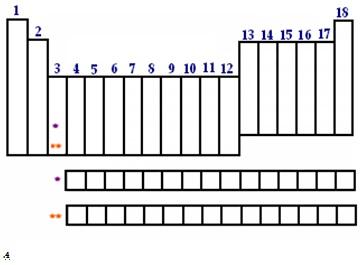
OBS: embora apareça no grupo 1, o Hidrogênio NÃO é um metal alcalino.
Blocos
Além das famílias e dos grupos, há também os blocos, outra divisão da tabela que leva em consideração os subníveis s, p, d e f dos elementos na distribuição eletrônica.
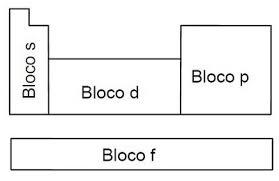
Os elementos são ainda classificados em metais, não metais, semimetais, gases nobres e há a colocação do Hidrogênio como autossuficiente em características, não sendo um metal.
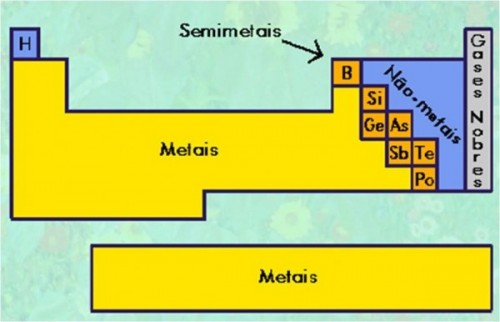
Concluímos
aqui a análise da tabela periódica dos elementos. Compreendê-la é de
suma importância para o estudo da Química e para facilitar o
entendimento dos assuntos da disciplina. No próximo artigo falaremos das
propriedades periódicas.
Até a próxima!
O post A Tabela Periódica dos Elementos Químicos apareceu primeiro no infoEnem.
ESTUDE COM OS MELHORES MATERIAIS PARA O ENEM:
Baixe gratuitamente os e-Books: Manual do Sisu 2016 / Manual do Prouni 2016
Dmitri Mendeleev
Dmitri Mendeleev foi um importante químico que desenvolveu estudos sobre as propriedades dos elementos e suas massas atômicas.
Dmitri Mendeleev em seus estudos
O químico de origem russa, Dmitri Mendeleev (1834-1907),
tornou-se um dos maiores gênios da história. Tal consagração se deveu ao
seu trabalho relacionado à periodicidade dos elementos químicos.
Mendeleev realizou estudos sobre as propriedades dos elementos e suas massas atômicas. Em 1869, ele começou a colecionar todas as informações sobre os elementos conhecidos na época, sob a forma de um manual. Os dados eram anotados em cartões, os quais eram afixados na parede de seu laboratório e, conforme observava alguma semelhança, mudava a posição dos cartões. Em meio à sequência de cartões existiam espaços vazios, e Mendeleev compreendeu que tais lacunas eram destinadas à descoberta de novos elementos, no futuro.
A organização dos elementos foi apresentada por Mendeleev à comunidade científica, e deu origem ao que atualmente conhecemos como “Tabela Periódica”, na qual os elementos estão dispostos em filas horizontais, de acordo com as massas atômicas crescentes, e também em colunas verticais, com elementos de propriedades semelhantes.
A previsão de Mendeleev quanto às propriedades dos elementos a serem descobertos estava certa. A prova concreta surgiu com a chegada dos elementos, gálio e germânio. Eles foram posicionados na tabela, justamente onde Mendeleev predeterminou, ou seja, suas propriedades já eram conhecidas.
Mendeleev realizou estudos sobre as propriedades dos elementos e suas massas atômicas. Em 1869, ele começou a colecionar todas as informações sobre os elementos conhecidos na época, sob a forma de um manual. Os dados eram anotados em cartões, os quais eram afixados na parede de seu laboratório e, conforme observava alguma semelhança, mudava a posição dos cartões. Em meio à sequência de cartões existiam espaços vazios, e Mendeleev compreendeu que tais lacunas eram destinadas à descoberta de novos elementos, no futuro.
A organização dos elementos foi apresentada por Mendeleev à comunidade científica, e deu origem ao que atualmente conhecemos como “Tabela Periódica”, na qual os elementos estão dispostos em filas horizontais, de acordo com as massas atômicas crescentes, e também em colunas verticais, com elementos de propriedades semelhantes.
A previsão de Mendeleev quanto às propriedades dos elementos a serem descobertos estava certa. A prova concreta surgiu com a chegada dos elementos, gálio e germânio. Eles foram posicionados na tabela, justamente onde Mendeleev predeterminou, ou seja, suas propriedades já eram conhecidas.
http://mundoeducacao.bol.uol.com.br/quimica/dmitri-mendeleev.htm















.webp)




















0 Comentários