Apostila preparatória para o concurso da prefeitura municipal do Natal
Os
gases têm um papel essencial para a vida, os gases atmosféricos
permitem, por exemplo, a respiração. Assim como eles são biologicamente
essenciais, são cobrados em vestibulares tanto em questões de química como a física.
Variáveis de Estado
As
variáveis de estado de um gás são: temperatura (T) que está associada á
energia cinética das moléculas em movimento, o volume (V) que é o
espaço ocupado pelo gás (os gases ocupam todo o volume dos recipientes
que os contém) e a pressão (p) que é associada às colisões das moléculas
do gás com as paredes dos recipientes. Essas variáveis descrevem a
condição física do gás.
Mudanças de Estado
Para as
mudanças de estado, mantemos sempre uma das variáveis de estado
constante e variamos as outras duas que sobraram. Existem tipos de
transformações, e elas dependem de qual a variável considerada como
constante, abaixo estão descritas três mudanças de estado:
- Transformação isotérmica: nessa transformação a temperatura é a variável mantida
constante; - Transformação isométrica, isocórica ou isovolumétrica: nessa transformação o
volume é a variável mantida constante; - Transformação isobárica: nessa transformação a pressão é a variável mantida
constante;
Se nenhuma das três variáveis de estados forem constantes atemos a transformação geral.
Transformação isotérmica – Lei de Boyle
A
pressão é o volume são variáveis inversamente proporcionais, ou seja, à
medida que eu aumento a pressão eu diminuo o volume. A partir dessa
afirmação concluímos que o produto da pressão pelo volume é uma
constante, então escrevemos:
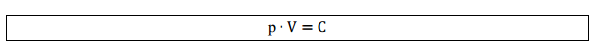
Assim, para transformações de um estado 1 para um estado 2 mantendo a temperatura constante:
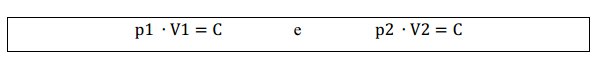
Igualando as duas equações:
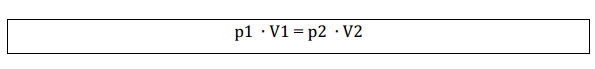
Graficamente representado por:
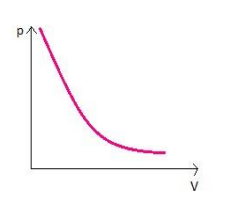
O
gráfico descreve uma hipérbole, mostrando que o volume é inversamente
proporcional à pressão como afirmado anteriormente. Essa curva recebe o
nome de isoterma devido à temperatura constante. Em um gráfico como esse
podem ser construídas várias isotermas ao mudar as temperaturas, mas
mantê-las constantes.
Transformação isométrica – Lei de Gay-Lussac
À
medida que aumentamos a temperatura de um gás, a pressão aumenta então
as variáveis pressão e temperatura são diretamente proporcionais, ou
seja:
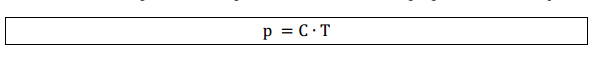
Assim, para transformações de um estado 1 para um estado 2 mantendo o volume constante:
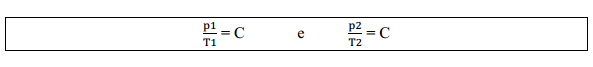
Igualando as duas equações:
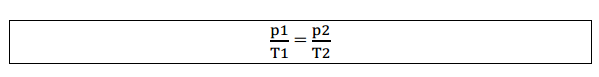
Graficamente representado por:
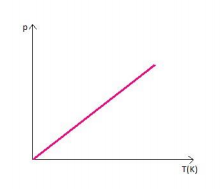
O gráfico descreve uma reta denominada isométrica, mostrando que a temperatura e pressão são diretamente proporcionais.
Transformação isobárica – Lei de Charles
À
medida que aumentamos a temperatura de um gás, há um aumento de volume,
mostrando que as variáveis temperatura e volume são proporcionais, ou
seja:
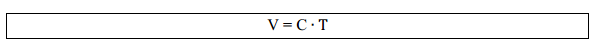
Assim, para transformações de um estado 1 para um estado 2 mantendo a pressão constante:
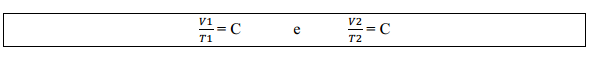
Igualando as duas equações:
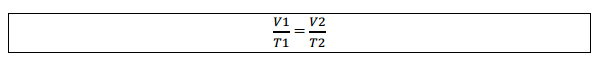
Graficamente representado por:
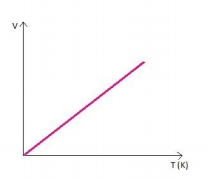
O gráfico descreve uma reta denominada isóbara, mostrando que a temperatura e volume são diretamente proporcionais.
O post Química no Enem – Transformações Gasosas apareceu primeiro no infoEnem.
Apostila preparatória para o concurso da prefeitura municipal do Natal






























0 Comentários